АЛОТРОПІЯ. АЛОТРОПНІ МОДИФІКАЦІЇ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ
Опанувавши матеріал параграфа, ви зможете:
- пояснювати суть явища алотропії; відмінності властивостей алотропних модифікацій Оксигену, Сульфуру, Карбону та Фосфору за допомогою їхнього кількісного складу або будови;
- досліджувати адсорбційну здатність активованого вугілля та аналогічних лікарських препаратів;
- обґрунтовувати значення алотропних перетворень;
- доводити практичну значущість явища адсорбції;
- висловлювати судження щодо біологічної ролі озону та його застосування.
Алотропія. Неметалічні елементи можуть утворювати кілька простих речовин, відмінних за складом молекул і будовою.
• Алотропія (від грецьк. allos – інший, tropos – властивість) – явище утворення хімічним елементом двох або більше простих речовин, різних за властивостями та будовою. Прості речовини одного елемента називають алотропними модифікаціями .
Алотропні модифікації властиві Оксигену, Сульфуру, Карбону та Фосфору. Ознайомимося докладніше з простими речовинами кожного з цих елементів.
Алотропні модифікації Оксигену. Оксиген утворює дві прості речовини: кисень та озон. Порівняємо їх склад та властивості (табл. 5).
Таблиця 5
Порівняльна характеристика кислорода та озону

Кисень під дією високої температури, електричного розряду або ультрафіолетового випромінювання перетворюється на озон, що відображає рівняння:
![]()
Реакція оборотна, тобто озон розкладається до кислорода і атомарного оксигену. Оксиген сполучається в молекулі кислорода. Цей процес відображає рівняння:
![]()
або сумарно:
![]()
Кисень та озон відрізняються хімічною активністю. Вам уже відомо, що кисень є добрим окисником під час реакцій з металами та деякими неметалами. Однак реакційна здатність озону значно вища завдяки тому, що під час його розпаду утворюється атомарний оксиген. Це зумовлює самозаймання деяких речовин в озоні, знебарвлення барвників, хрупкість каучуків.
Наявність кислорода у повітрі забезпечує всі життєві процеси у живих організмах. Завдяки кислороду відбувається процес дихання. Однак надмірна його кількість в організмі призводить до пришвидшення обмінних процесів, що спричиняє зношування організму. Кисень застосовують для різання та зварювання металів у суміші з етином (ацетиленом) і як окисник палива в ракетних двигунах. У медицині кислородом наповнюють кисневі подушки для хворих, у яких утруднене дихання.
Озон — отруйна речовина, але в малій кількості є добрим антисептиком, тому його застосовують для озонування води й повітря. У суміші з киснем використовують як окисник ракетного палива; для відбілювання тканин.
Озоновий шар захищає Землю від сонячної радіації.
У промисловості кисень добувають зі зрідженого повітря, перегонкою або електролізом води. У лабораторних умовах — розкладом оксигеновмісних речовин, зокрема калій перманганату KMnO4, гідроген пероксиду H2O2, калій хлорату KClO3, натрієвої NaNO3 чи калієвої KNO3 селітр.
Складіть самостійно рівняння реакцій електролізу води й розкладу оксигеновмісних органічних речовин, які ви вивчали в попередніх класах.
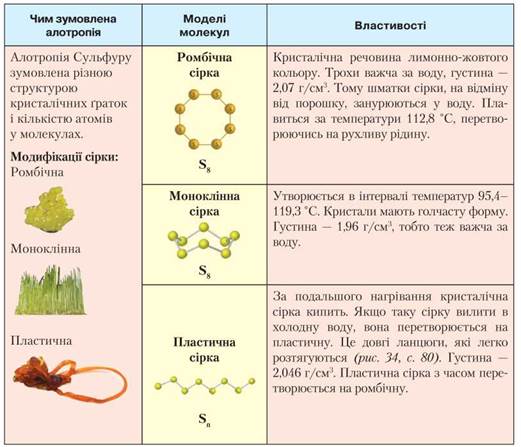
Алотропні модифікації Сульфуру. Сульфур — елемент 3 періоду головної підгрупи VI групи. На зовнішньому (третьому) енергетичному рівні його атома міститься 6 електронів. Електронна конфігурація атома — 3s23p4.
Сульфур утворює декілька алотропних модифікацій, зокрема кристалічну та пластичну сірку. Кристалічна сірка має дві форми: ромбічну та моноклінну. Ознайомимося з ними докладніше (табл. 6).
Таблиця 6
Порівняльна характеристика алотропних модифікацій Сульфуру
Сірка набула широкого застосування у різних галузях виробництва. Зокрема в промисловості органічного синтезу — для вулканізації каучуку, у виробництві сірників, отрутохімікатів, які використовують у боротьбі з хворобами та шкідниками рослин (бавовнику, виноградної лози). Її застосовують як антисептик у фармацевтичній промисловості для виробництва мазей (наприклад, сірчаної мазі для лікування захворювань шкіри). У хімічній промисловості — для виробництва сульфатної кислоти та її солей.

Рис. 34. Процес перетворення кристалічної сірки на пластичну
Алотропні модифікації фосфору. Фосфор - елемент 3 періоду, головної підгрупи V групи. Тому зовнішній (третій) енергетичний рівень його атома має електронну конфігурацію 3s 2 3p 3 .За звичайних умов фосфор є твердою речовиною, пара якої містить молекули Р 4 . У природі у вільному стані не трапляється.
Фосфор утворює три алотропні модифікації: білий, червоний та чорний (табл. 7). Як і всі неметали, реагує з кислородом. Білий фосфор — активніший, і вже за температури 50 °С загоряється у повітрі. Менш активний червоний фосфор горить у надлишку кислорода, якщо його підпалити. Рівняння реакції:
4Р + 5О2 = 2Р2О5 . _
Таблиця 7
Порівняльна характеристика алотропних модифікацій Фосфору

Продовження табл. 7

Алотропні модифікації Карбону. Карбон – елемент 2 періоду головної підгрупи IV групи. Тому зовнішній (інший) енергетичний рівень його атома має електронну конфігурацію 2s 2 2p 2 . Завдяки особливій будові атомів Карбону він існує у вигляді кількох алотропних модифікацій — як природних, так і штучно здобутих.
У курсі хімії 8 класу ви вивчили кристалічну будову та фізичні властивості однієї з алотропних модифікацій Карбону — алмазу. Алмаз та графіт — це природні модифікації Карбону, кристалічні структури яких різко відрізняються. Крім них, відомі карбін і фулурен. Пригадаємо деякі властивості алмазу та графіту.
Алмаз (від грецьк. adamas — твердий) — природна модифікація з атомними кристалічними ґратками, найтвердіший серед інших речовин. Це безбарвні прозорі кристали, які не змочуються водою. Дуже тугоплавкий, з температурою плавлення 4000 °С. Не проводить електричного струму, але добре проводить тепло. Якщо діяти на алмаз рентгенівським чи ультрафіолетовим промінням, то він світиться блакитним або жовтим світлом. Характерною властивістю алмазу є здатність добре заломлювати світло, розкладаючи його на цілий спектр кольорів. Завдяки цьому алмази застосовують у ювелірній справі. Алмази не розчиняються ні в кислотах, ні в інших сильних розчинниках.
Графіт (від грецьк. grafo — пишу) — речовина сірого або чорного кольору, з металічним блиском, непрозора, жирна на дотик. Належить до тугоплавких сполук, з температурою плавлення 3800 °С. Порівнюючи з алмазом, графіт м'який, добре проводить електричний струм і теплоту.
Алмаз і графіт можуть взаємоперетворюватися. За нагрівання алмазу до температури понад 1000 °С без доступу повітря він перетворюється на графіт. За вищих температур (1200-1600 °С) і наявності каталізатора графіт перетворюється на алмаз. Цю властивість узято за основу виготовлення штучних алмазів.
З іншими алотропними модифікаціями Карбону ознайомимося за табл. 8.
Таблиця 8
Алотропні модифікації Карбону


Розалінд Елсі Франклін (1920-1958) - британська вчена-біофізик і кристалограф. Створила підґрунтя для висунення гіпотези про структуру підвійної спіралі молекули ДНК, що у 1953 р. задекларували американські вчені Дж. Ватсон та Ф. Крік.
Керуючись бажанням зробити свій внесок у перемогу в Другій світовій війні, із серпня 1942 р. працювала в Британській дослідницькій асоціації з використання вугілля і вивчала його пористу структуру. Її робота сприяла зародженню ідеї про високоміцне углецеве, або графітове, волокно — штучне волокно, що складається з вуглецю і має графітову структуру, тобто атоми Карбону розташовані в тонкі довгі графітові волокна. Ця ідея була основою її докторської дисертації «Фізична хімія твердих органічних колоїдів на прикладі вугілля та пов'язаних з ним матеріалів».
ДОМАШНЄ ЗАВДАННЯ
- 1. Поясніть суть явища алотропії на прикладах.
- 2. Охарактеризуйте алотропні модифікації: а) оксигену; б) Сульфур; в) фосфору; г) Карбону.
- 3. Складіть рівняння реакцій: а) сірки з магнієм, алюмінієм, водородом, кислородом; б) кислорода з міддю, водородом; в) фосфору з кислородом, сіркою, кальцієм; г) вуглецю з водородом, кислородом, ферум(ІІ) оксидом, хром(ІІІ) оксидом. Розгляньте реакції як окисно-відновні.
- 4. Позначте прості речовини, що є алотропними модифікаціями одного елемента.
А сірка, сульфур(IV) оксид
Б бор, бор оксид
В алмаз, фулерен
Г карбон, карбон(IV) оксид
- 5. Вкажіть модифікацію Карбону, твердішу за сталь.
А фулерен
Б алмаз
У графен
Г графіт
- 6. Вкажіть просте речовину, що світиться у темряві.
А пластична сірка
Б червоний фосфор
В алмаз
Г білий фосфор
- 7. Позначте окисник і відновник у реакції, що відбувається за схемою:
ZnO + C → Zn + CO 2 ↑.
А відновник С +2
Б окислювач Zn 0
В окисник Zn +2
Г відновник С 0
- 8. Під час згоряння вуглецю в атмосфері кислорода утворився карбон(IV) оксид об'ємом 112 л (н. у.). Обчисліть масу вуглецю й прореагували об'єм кислорода.
- 9. У лабораторії провели експеримент на відновні властивості водороду. Через порошок купрум(ІІ) оксиду масою 1,6 г пропустили водород у надлишку. Обчисліть обсяг водороду (н. у.), що витратився, і масу та кількість речовини міді, що утворилася.
- 10. Цинк оксид масою 32,4 г повністю відновили вуглецем. Обчисліть масу цинку та об'єм карбон(IV) оксиду (н. у.), що утворилися. Якому кількості речовини відповідає такий обсяг?
Немає коментарів:
Дописати коментар